Hiệu ứng hyperconjugation xưa nay được coi là một hiệu ứng khó, nếu đi sâu về bản chất thì trong những thập kỉ 60 -70 anh em pro trên thế giới tranh luận với nhau ko ngớt, và cho đến nay thì rất hiếm sách Việt Nam nào có nói thật kĩ phần này. Hôm nay BM sẽ giới thiệu một chút sâu vào bản chất của hiệu ứng này, trong phần đầu là phần tạo các orbital nhóm, BM trích bài của anh DNT, vì có thể nói bài này anh ấy viết quá xuất sắc về cách diễn đạt (đúng là pro có khác ) !!!
Thuyết MO, cùng nhau ôn lại vài nét chính !
Trước khi đi vào tâm của câu hỏi : thuyết MO giải thích Hyperconjugation thế nào ? các bạn hãy cùng tôi điểm lại một số nét chính của thuyết này. Chúng ta sẽ chỉ nhìn vấn đề một cách định tính, không đi vào các biểu thức toán. Tôi xin trích một câu nói nổi tiếng của C.A. Coulson , một nhà hóa học lý thuyết lớn của thế kỷ trước : “Contrary to what is sometimes supposed, the theoretical chemist is not a mathematician, thinking mathematically, but a chemist, thingking chemically” (6).
Điểm khác biệt đầu tiên giữa thuyết VB và thuyết MO là : thuyết VB lắp ghép (assemble) cùng một lúc cả hạt nhân và e của các nguyên tử để tạo phân tử. Câu nói sau đây theo ngôn ngữ thuyết VB mà chúng ta đã đều nghe từ hồi còn học phổ thông : Nguyên tử A đưa một e ra dùng chung với một e của nguyên tử B để tạo thành một liên kết cộng hóa trị (Valence Bond) với 2e. Còn thuyết MO chỉ lắp ghép các hạt nhân nguyên tử để tạo thành khung phân tử, bằng cách tổ hợp tuyến tính các orbital nguyên tử (LCAO). Các e không còn thuộc về các nguyên tử riêng rẽ, hoặc một liên kết cụ thể nào nữa, mà là của toàn bộ phân tử. (7). Sau khi có được bộ khung phân tử rồi, các e được đưa vào các MO theo 1) Nguyên tắc xây dựng (Aufbau); 2) Nguyên lý loại trừ Pauli; 3) Quy tắc Hund để xây dựng cấu hình e (electronic configuration) của phân tử, giống hệt như ta làm với nguyên tử vậy.
Theo tôi, hiểu rõ sự khác biệt này rất quan trọng. Ví dụ, các bạn sẽ không phải đặt vấn đề đại loại như : Hiệu ứng siêu liên hợp trong gốc tự do ethyl là do sự xen phủ của orbital SIGMA của liên kết C-H với orbital p chứa điên tử độc thân của gốc …” nữa (Hoặc tương tự khi các bạn nói đến Hyperconjugation của Cation và Carbanion). Chúng ta sẽ tạo các MO trước (bằng cách nào ? tôi sẽ trình bày trong các phân tiếp theo), rồi sau đó, bằng cách thêm hoặc bớt e, chúng ta sẽ có gốc tự do, cation hay carbanion.
Không phải chỉ có 2 AO tổ hợp được với nhau và không phải 2 AO bất kì nào cũng có thể tổ hợp được với nhau. Nhiều AO có thể tổ hợp được với nhau nếu chúng thỏa mãn 2 điều kiện sau : 1) Các AO có năng lượng bằng hoặc hoặc không quá xa nhau (GAP); 2) Các AO tham gia tổ hợp phải có tính đối xứng (symmetry) giống nhau trong không gian.
Dấu (+) và (-) trên các AO là dấu của hàm sóng, bản thân nó không có nghĩa vật lý. Vì vậy, hầu hết các sách dùng màu để biểu thị (tôi dùng 2 màu xanh/trắng hoặc đen/trắng). Tuy nhiên, khi tổ hợp các AO, thì chỉ có phần cùng dấu (cùng màu) là có thể tổ hợp được với nhau. Tổ hợp sẽ bằng 0 nếu 2 AO “chéo nhau” (orthogonal).
Bây giờ, hãy quan sát giản đồ MO của phân tử đơn giản nhất của hóa Hữu cơ : Methane. Các AO hóa trị (lớp ngoài) sau sẽ tổ hợp được với nhau : AO 2s và 3 AO 2p (theo 3 trục xyz) của C tổ hợp với 4 AO 1s của 4 nguyên tử H (AO 1s của C nằm ở lớp trong, ta không tổ hợp). Tổng cộng, sẽ có 8 AO tổ hợp với nhau để tạo thành 8 MO (4MO liên kết – bonding và 4MO phản liên kết – antibonding) và số e để điền vào các MO là 8e (4e từ C và 4x1e từ 4H). Trong hình 3, các bạn sẽ chỉ nhìn thấy 4 MO liên kết của CH4. [8]
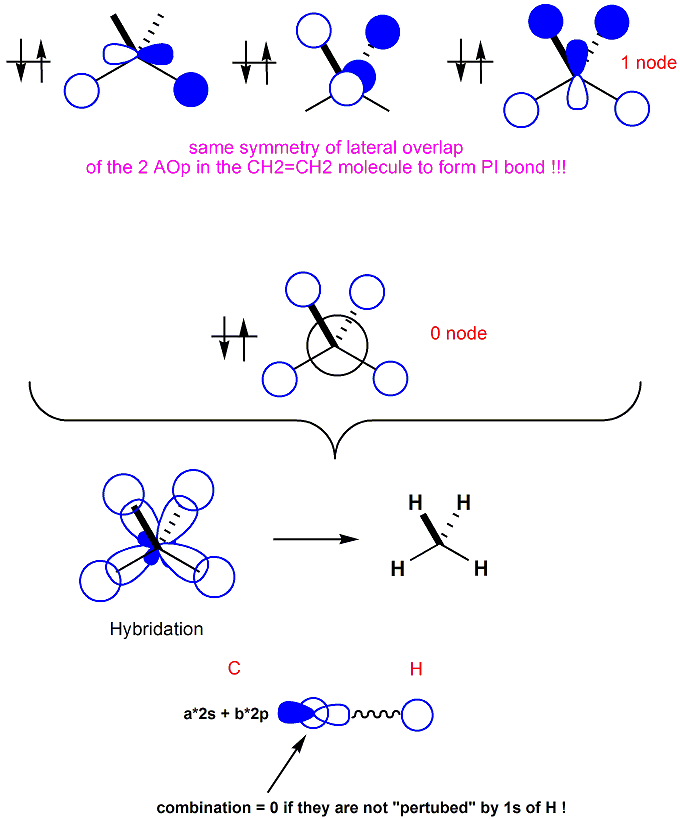
Hình 3 : MOs liên kết của Methane
Các MO được xếp theo thứ tự tăng dần về năng lượng. Năng lượng càng lớn nếu số NƠ (node) xuất hiện trong mỗi MO càng nhiều. Với các MO có một nơ, tính đối xứng của chúng làm chúng ta liên tưởng đến sự xen phủ bên (lateral overlap) của các orbital p để tạo liên kết PI (trong ethylene chẳng hạn).
Nhìn các MO trong hình 3, ta khó có thể tìm lại được hình ảnh “tứ diện đều, có tâm là nguyên tử C và 4 đỉnh là 4 nguyên tử H” mà thuyết VSEPR (Valence Shell Electron Pairs Repulsion) đã dự báo. Để đảm bảo tính nhất quán, thuyết Lai Hóa (Hybridation) ra đời.
Về thực chất, Lai Hóa là sự tổ hợp tuyến tính của các AO trong một nguyên tử thành các AO lai hóa (hybrided AOs) rồi mới đem chúng đi tổ hợp với các AO của các nguyên tử khác để tạo MO.
Phía bên dưới hình 3 là hình ảnh phân tử CH4 mà trong đó 4AO (2s và 3 AO px, py, pz của C) tổ hợp lại thành 4AO sp3, hướng ra 4 hướng khác nhau của tứ diện đều để tổ hợp với 4AO 1s của H. Tổ hợp như vậy, ta lại tìm thấy hình ảnh quen thuộc của phân tử Methane.
Chú ý rằng, như đã nói ở trên, “Tổ hợp sẽ bằng 0 nếu 2 AO “chéo nhau” (orthogonal).”, nhưng sở dĩ các AO sp3 tổ hợp được là do trước đó, các AO của C đã bị “xáo trộn” (perturbed) bởi AO 1s của H. (Đây là lần đầu tiên tôi dùng ngôn ngữ của Pertubation Theory, trong các phần tiếp theo, tôi sẽ tiếp tục dùng ngôn ngữ này mà không đi vào các biểu thức toán chi tiết).